Kalorimeter – Pengertian, Prinsip Kerja, Rumus, Jenis & Contoh – Untuk pembahasan kali ini kami akan mengulas mengenai Kalorimeter yang dimana dalam hal ini meliputi pengertian, prinsip kerja, rumus, jenis dan contoh, nah agar dapat lebih memahami dan dimengerti simak ulasan selengkapnya dibawah ini.

Pengertian Kalorimeter
Kalorimeter adalah alat untuk mengukur jumlah kalor yang terlibat pada suatu perubahan atau reaksi kimia. Proses dalam kalorimeter berlangsung secara adiabatik, yaitu tidak ada kalor yang keluar atau masuk dari kalorimeter. Kalorimetri adalah proses pengukuran jumlah kalor reaksi yang diserap atau dilepaskan pada suatu reaksi kimia dalam suatu eksperimen.
Data-data perubahan entalpi reaksi yang terdapat pada tabel merupakan hasil perhitungan kalorimetri. Dengan menggunakan kalorimetri kita dapat menentukan apa jenis reaksi yang terjadi, apakah reaksi tersebut endoterm ataupun eksoterm. Kalorimetri yang sederhana ialah proses mengukur perubahan suhu air atau larutan sebagai akibat dari suatu reaksi kimia dalam suatu wadah terisolasi.
Prinsip Kerja Kalorimeter
Prinsip kerja kalorimeter berdasarkan azas black yang berbunyi “kalor yang dilepas oleh benda panas sama dengan kalor yang diterima oleh benda dingin”. Jadi ketika dua buah benda didekatkan satu sama lainnya maka akan terjadi perpindahan kalor dari benda panas ke benda dingin hingga mencapai suatu kesetimbangan termal atau mencapai suhu setimbang.
Dalam kasus kalorimeter, bagian benda yang panas adalah wadah penampung sampel yang akan memberikan panas, sedangkan bagian benda dingin adalah benda yang akan menerima panas tersebut, biasanya berupa air.
Pada sistem tertutup kekekalan energi panas dapat dituliskan sebagai berikut:

Besaran-besaran yang biasanya digunakan pada persamaan atas adalah:
Q = banyaknya kalor (J)
m = massa zat (kg)
c = kalor jenis zat (J/kgoC)
∆T = perubahan suhu (oC)
C = kapasitas kalor suatu zat (J/oC)
Jenis-Jenis Kalorimeter
Berikut ini terdapat beberapa jenis-jenis kalorimeter, terdiri atas:
1. Kalorimeter Larutan
 Kalorimeter larutan adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat pada reaksi kimia dalam sistem larutan. Pada dasarnya, kalor yang dibebaskan/diserap menyebabkan perubahan suhu pada kalorimeter. Berdasarkan perubahan suhu per kuantitas pereaksi kemudian dihitung kalor reaksi dari reaksi sistem larutan tersebut. Kini kalorimeter larutan dengan ketelitian cukup tinggi dapat diperoleh di pasaran.
Kalorimeter larutan adalah alat yang digunakan untuk mengukur jumlah kalor yang terlibat pada reaksi kimia dalam sistem larutan. Pada dasarnya, kalor yang dibebaskan/diserap menyebabkan perubahan suhu pada kalorimeter. Berdasarkan perubahan suhu per kuantitas pereaksi kemudian dihitung kalor reaksi dari reaksi sistem larutan tersebut. Kini kalorimeter larutan dengan ketelitian cukup tinggi dapat diperoleh di pasaran.
Kalor yang timbul pada reaksi akan diterima ataupun diserap oleh sekeliling (lingkungan). Jadi terjadi perpindahan kalor dari sistem ke lingkungan atau sebaliknya. Apabila kita memandang larutan yang diuji sebagai sistem maka seluruh aspek diluar sistem disebut lingkungan termasuk juga dewar pada gambar di atas.
Jadi tidak seluruhnya kalor yang terlibat dipindahkan dari larutan ke air atau penerima panas, akan tetapi juga akan dipindahkan ke tempat kalorimeter tersebut. Sehingga perhitungannya menjadi:
 Keterangan:
Keterangan:
m= massa zat
c = kalor jenis zat penerima panas
C = kapasitas kalor kalorimeter
ΔT = Perubahan suhu
2. Kalorimeter Bom
 Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O2 berlebih) suatu senyawa, bahan makanan, bahan bakar. Satu hal yang perlu diperhatikan dalam kalorimeter bom adalah kalorimeter bom adalah jenis kalorimeter volume tetap. Sehingga dalam perhitungan tidak ada perubahan volume (usaha termodinamika = 0).
Kalorimeter bom adalah alat yang digunakan untuk mengukur jumlah kalor (nilai kalori) yang dibebaskan pada pembakaran sempurna (dalam O2 berlebih) suatu senyawa, bahan makanan, bahan bakar. Satu hal yang perlu diperhatikan dalam kalorimeter bom adalah kalorimeter bom adalah jenis kalorimeter volume tetap. Sehingga dalam perhitungan tidak ada perubahan volume (usaha termodinamika = 0).
Sejumlah sampel ditempatkan sebuah tabung di dalam kalorimeter, lalu pada tabung tersebut dialirkan oksigen dengan tekanan tinggi (25 atm). Untuk melakukan pembakaran (ignition), digunakan aliran listrik. Aliran listrik akan membakar sampel dengan oksigen berlebih. Kalor yang dilepas akan diserap oleh air sekitar sekaligus dengan wadahnya.
Tentu saja dalam perhitungan akan dilakukan koreksi, sehingga dilakukan kalibrasi kalorimeter. Koreksi tersebut meliputi input energi listrik, penyusutan kawat, pembentukan asam akibat oksidasi. Jadi pembakaran sempurna untuk senyawa yang mengandung S dan N biasanya akan terjadi perubahan pH.
Perhitungan pada kalorimeter bom hampir mirip dengan kalorimeter larutan yaitu:
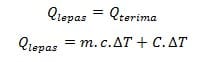
Namun, apabila dikaitkan dengan hukum-hukum termodinamika, maka perhitungannya:
- Kalorimeter bersifat adiabatis, kalor tidak ada yang keluar masuk dari kalorimeter. (Q = 0)
- Tidak ada usaha karena volume konstan (W=0)
![]()
- Larutan dipandang sebagai sistem.

Sebelum dilakukan pengukuran, biasanya kalorimeter bom dikalibrasi terlebih dahulu dengan menggunakan asam benzoat. Kawat yang mengalirkan arus listrik biasanya mengalami penyusutan. Maka perhitungannya:
![]()
Setelah Cv kalorimeter telah diketahui maka dapat dilakukan pengukuran entalpi pembakaran dari sampel.
Contoh Kalorimeter Bom

Kalorimeter 1271 menawarkan tingkat yang tiada bandingnya otomatisasi dengan dua kemampuan unik:
- FULL AUTOMATIC Bom Penanganan
Bom dibuka dan ditutup secara otomatis oleh pneumatik drive di bawah mikroprosesor kontrol. Operator hanya mamasukan sampel ke kepala bom, menempel sebuah kapas bantu rangkaian sekering dan menutup penjaga keamanan. Semua operasi kemudian dilanjutkan secara otomatis sampai akhir tes,ketika kalorimeter bom membuka dan melepaskan keselamatan penjaga bagi operator untuk menyisipkan sampel berikutnya.
- Diperluas Untuk A Dual Sistem
Melayani laboratorium dengan volume suara tinggi pengujian beban, Kalorimeter 1271 dirancang sedemikian rupa sehingga dapat diperluas untuk mencakup dua kalorimeter terpisah,mekanisme beroperasi dengan satu control, sehingga memberikan redundansi serta tambahan kapasitas. Dual operasi dicapai dengan menambahkan Kalorimeter 1272 Ekspansi, Modul dasar 1271 Sistem.
Contoh Perhitungan Kalorimeter
Terdiri atas:
1. Suatu kalorimeter bom berisi 250 ml air yang suhunya 25oC, kemudian dibakar 200mg gas metana. Suhu tertinggi yang dicapai air dalam kalorimeter = 35o Jika kapasitas kalor kalorimeter = 75 J/oC dan kalor jenis air = 4,2 J/goC. Berapakah entalpi pembakaran (ΔHc) dari gas metana?

ΔHc = -11250 J (tanda minus menandakan kalor keluar dari sistem ke lingkungan) untuk 200 mg gas metana.
BM CH4 = 16
Maka, mol metana = 0,2/16 = 0,0125 mol.
ΔHc untuk satu mol adalah = (-11250 J/ 0,0125) = -900 kJ
2. Sebanyak 50 mL ( = 50 gram ) larutan HCl 1 M bersuhu 27 oC dicampur dengan 50 mL ( = 50 gram ) larutan NaOH 1 M bersuhu 27 oC dalam suatu kalorimeter gelas stirofoam. Suhu campuran naik sampai 33,5 o Jika kalor jenis larutan = kalor jenis air = 4,18 J / g.K. Tentukan perubahan entalpinya!
(Kapasitas kalor kalorimeter dapat diabaikan.)

Jumlah mol ( n ) HCl = 0,05 L x 1 mol / L = 0,05 mol
Jumlah mol ( n ) NaOH = 0,05 L x 1 mol / L = 0,05 mol
Oleh karena perbandingan jumlah mol pereaksi = perbandingan koefisien reaksinya maka campuran tersebut adalah ekivalen.
ΔH = -2.717 J/ 0,05 mol = -54,34 kJ.
Demikianlah pembahasan mengenai Kalorimeter – Pengertian, Prinsip Kerja, Rumus, Jenis & Contoh semoga dengan adanya ulasan tersebut dapat menambah wawasan dan pengetahuan anda semua, terima kasih banyak atas kunjungannya. 🙂 🙂 🙂